
Nhiều lần vi phạm về lưu hành thuốc, CTCP Pymepharco bị phạt 100 triệu đồng
SKTD - Theo thông tin từ Cục Quản lý Dược, Công ty cổ phần Pymepharco (địa chỉ trụ sở chính: số 166-170, phố Nguyễn Huệ, phường 7, TP Tuy Hòa, tỉnh Phú Yên) mới đây đã bị xử phạt 100 triệu đồng do có nhiều lần vi phạm quy định về lưu hành thuốc theo quy định của pháp luật Việt Nam.
Cục Quản lý Dược (Bộ Y tế) mới đây cho biết, Công ty cổ phần Pymepharco tại địa chỉ nêu trên đã không thực hiện thủ tục đăng ký thay đổi, bổ sung giấy đăng ký lưu hành với cơ quan nhà nước có thẩm quyền và được phê duyệt trước khi lưu hành thuốc đối với thay đổi lớn cần được phê duyệt với thuốc Ciprofloxacin STADA 500 mg có số đăng ký VD-34964-21, theo quy định của pháp luật.
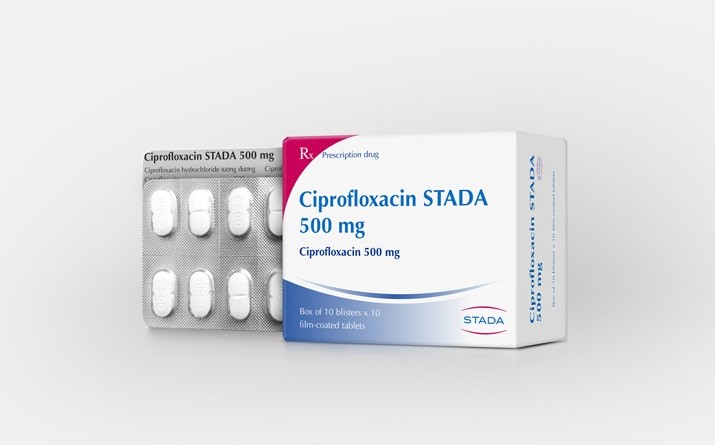
Theo quyết định của Cục Quản lý Dược, các tình tiết tăng nặng là Công ty cổ phần Pymepharco đã có vi phạm trên nhiều lần (đối với 19 lô thuốc), vi phạm điểm b khoản 1 Điều 10 Luật xử lý vi phạm hành chính năm 2012. Không có tình tiết giảm nhẹ.
Cục Quản lý Dược, Bộ Y tế yêu cầu Công ty cổ phần Pymepharco nghiêm chỉnh chấp hành quyết định xử phạt này. Nếu quá thời hạn mà Công ty cổ phần Pymepharco không tự nguyện chấp hành thì sẽ bị cưỡng chế thi hành theo quy định của pháp luật.
Công ty phải nộp số tiền phạt nói trên vào ngân sách nhà nước, qua Kho bạc Nhà nước thành phố Hà Nội trong vòng 10 ngày, kể từ ngày nhận quyết định xử phạt.
Thuốc Ciprofloxacin là kháng sinh, được chỉ định điều trị cho các nhiễm khuẩn nặng. Thuốc được sử dụng theo đơn của bác sĩ.
Cùng trong thời gian này, Cục Quản lý Dược cũng ra quyết định thu hồi Giấy đăng ký lưu hành thuốc tại Việt Nam đối với 30 thuốc.
Theo đó, trong 30 loại thuốc bị thu hồi giấy đăng ký lưu hành tại Việt Nam này, chủ yếu được sản xuất ở Hàn Quốc (16/30 loại). Cùng với đó là các loại thuốc sản xuất tại: Đức, Pháp, Ấn Độ, Tây Ban Nha, Singapore...
Các thuốc bị thu hồi, có thuốc làm giảm triệu chứng trong điều trị thoái hóa khớp, viêm khớp dạng thấp (Celofirm 200); thuốc sát trùng quanh mắt trước khi phẫu thuật (Sofilim Eye drop). Ngoài ra, có các thuốc điều trị chứng bệnh dạ dày - ruột, rối loạn tiêu hóa; điều trị bệnh lý ký sinh trùng, nhiễm khuẩn hô hấp...

Theo Quyết định do ông Nguyễn Thành Lâm - Phó Cục trưởng Cục Quản lý Dược kí, lý do thu hồi là các cơ sở sản xuất hoặc cơ sở đăng ký thuốc, nguyên liệu làm thuốc đề nghị thu hồi giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc tại Việt Nam (theo quy định tại Điểm g, Khoản 1 Điều 58 Luật Dược số 105/2016/QH13 và Khoản 2 Điều 42 Thông tư số 32/2018/TT-BYT).
Thuốc được sản xuất trước ngày quyết định có hiệu lực và đã nhập khẩu vào Việt Nam; hoặc thuốc nước ngoài nhập khẩu trong trường hợp được giao hàng tại cảng đi của nước xuất khẩu trước ngày quyết định có hiệu lực tiếp tục được phép lưu hành đến hết hạn dùng của thuốc.
Cơ sở đăng ký thuốc, sản xuất thuốc phải có trách nhiệm theo dõi và chịu trách nhiệm về chất lượng, an toàn, hiệu quả của thuốc trong quá trình lưu hành.
Link nội dung: https://suckhoetoday.com.vn/nhieu-lan-vi-pham-ve-luu-hanh-thuoc-ctcp-pymepharco-bi-phat-100-trieu-dong-a2152.html