Triển khai thực hiện Hiệp định Mỹ phẩm ASEAN và quy định tại Thông tư số 06/2011/TT-BYT ngày 25/1/2011 của Bộ trưởng Bộ Y tế quy định về quản lý mỹ phẩm, căn cứ kết quả các cuộc họp Hội đồng Mỹ phẩm ASEAN (ACC) lần thứ 40 và Hội đồng Khoa học mỹ phẩm ASEAN (ACSB) lần thứ 40, Cục Quản lý Dược thông báo đến các Đơn vị như sau:
1. Các Phụ lục (Annexes) của Hiệp định Mỹ phẩm ASEAN bao gồm:
- Phụ lục II. Danh mục các chất không được phép sử dụng trong sản phẩm mỹ phẩm;
- Phụ lục III. Danh mục các chất có quy định giới hạn nồng độ, hàm lượng trong sản phẩm mỹ phẩm;
- Phụ lục IV. Danh mục các chất màu được phép dùng trong sản phẩm mỹ phẩm;
- Phụ lục VI. Danh mục các chất bảo quản được phép sử dụng trong sản phẩm mỹ phẩm;
- Phụ lục VII. Danh mục các chất lọc tia tử ngoại trong sản phẩm mỹ phẩm.



2. Thông tin về cập nhật, sửa đổi nội dung tại các Phụ lục của Hiệp định Mỹ phẩm ASEAN cụ thể như sau:
2.1. Tại Phụ lục II. Được cập nhật, sửa đổi nội dung như sau:
2.1.1. Tham chiếu số A1137 (Theophylline): cập nhật tên chất “Theophylline; 1,3-dimethyl-3,7-dihydro-1H-purine-2,6-dione”.
2.1.2. Tham chiếu số 46: bổ sung chất Barium Peroxide (and Barium Peroxide). Ngày áp dụng tại Việt Nam: Kể từ ngày 19/11/2025.
2.1.3. Bổ sung 24 số tham chiếu (24 chất) sau:
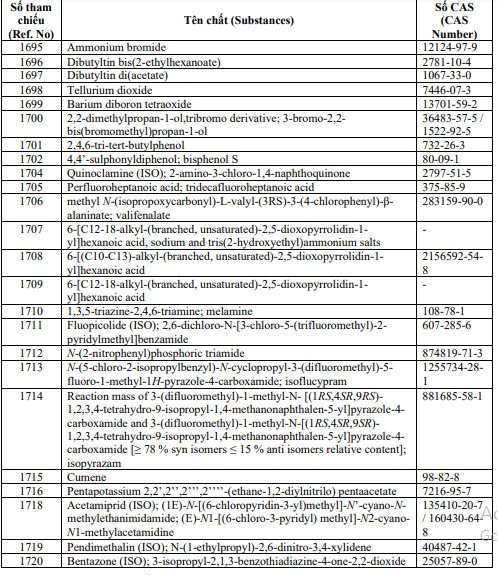
Ngày áp dụng: Kể từ ngày ký Công văn này.
2.1.4. Bổ sung tham chiếu số 1703 (Benzophenone, Except Thailand) và tham chiếu số 1717 (N-Carboxymethyliminobis(ethylenenitrilo)tetra(acetic acid); Axit Pentetic (INCI), Except Thailand). Ngày áp dụng: Kể từ ngày 19/11/2026. 2.2. Tại Phụ lục III. Được cập nhật, sửa đổi như sau: - Bổ sung tham chiếu số 342 (2,6-Di-Tert-Butyl-4-Methylphenol; Butylated Hydroxytoluene, CAS No. 128-37-0) với giới hạn nồng độ tối đa được phép sử dụng: 0,001% trong nước súc miệng, 0,1% trong kem đánh răng và 1% trong các sản phẩm lưu lại và rửa trôi khác. Ngày áp dụng: Kể từ ngày 19/11/2026.
2.3. Tại Phụ lục IV. Danh mục các chất màu được phép dùng trong sản phẩm mỹ phẩm: Không có cập nhật, sửa đổi nội dung.
2.4. Tại Phụ lục VI. Danh mục các chất bảo quản được phép sử dụng trong sản phẩm mỹ phẩm: Không có cập nhật, sửa đổi nội dung.
2.5. Tại Phụ lục VII: Được cập nhật, sửa đổi nội dung như sau:
- Số tham chiếu 3 (Homosalate (INN), CAS No. 118-56-9): giới hạn nồng độ tối đa được phép sử dụng 7,34% đối với các sản phẩm dành cho mặt ngoại trừ các sản phẩm dạng xịt (Face products with the exception of propellent spray products). Ngày áp dụng: Kể từ ngày 19/11/2027.
2.6. Lộ trình áp dụng: Kể từ ngày áp dụng nêu tại Công văn này, chỉ các sản phẩm mỹ phẩm đáp ứng quy định mới được lưu hành trên thị trường, các sản phẩm mỹ phẩm không đáp ứng quy định sẽ bị thu hồi.
3. Đề nghị các cơ sở sản xuất, kinh doanh mỹ phẩm:
- Chủ động rà soát thành phần công thức sản phẩm mỹ phẩm được sản xuất, nhập khẩu, kinh doanh;
- Có kế hoạch sản xuất, nhập khẩu, kinh doanh phù hợp, bảo đảm sản phẩm mỹ phẩm đưa ra lưu hành đáp ứng quy định tại Thông tư số 06/2011/TTBYT ngày 25/01/2011 của Bộ trưởng Bộ Y tế quy định về quản lý mỹ phẩm, Hiệp định Mỹ phẩm ASEAN, các nội dung cập nhật Hiệp định Mỹ phẩm ASEAN được nêu tại Công văn này và các công văn cập nhật quy định về các chất dùng trong mỹ phẩm của Cục Quản lý Dược; tránh nguy cơ sản phẩm bị thu hồi, gây lãng phí.
4. Đề nghị Sở Y tế các tỉnh, thành phố trực thuộc Trung ương phổ biến đến các đơn vị trên địa bàn biết và triển khai thực hiện các nội dung nêu tại Mục 1, 2 và 3 Công văn này.